Съвет 1: Как да изчислявам титъра
Съвет 1: Как да изчислявам титъра
титър Е израз на концентрацията на разтвор на вещество,се използва в аналитичната химия. Обозначава масата на разтвореното вещество на единица обем разтвор. Титърът на разтвора в аналитичната химия може да се определи по титриметричен метод.

Ще ви трябва
- - дръжката;
- - хартия за записи;
- - калкулатор;
- - Периодична система от химически елементи (таблицата на Менделеев).
инструкция
1
С този метод, обемите на дверазтвори, единият от които е аналит, а другият титриран или титруван разтвор с известна концентрация. За титран, съществува понятието условен титър или титър за дадено вещество. Това е количеството на тестваното вещество, титрувано с 1 ml от разтвора. В курса на обучение по химия има няколко вида задачи за изчисляване на титъра на решение.
2
В първия тип задачи трябва да преведетеконцентрацията на разтвора от другите единици в титъра. Концентрацията е съотношението на количеството разтворено вещество, определената маса, броя на моловете, обема, размера на разтвора или разтворителя. В решението се основава на факта, че за да се определи титърът на оригиналните данни трябва да получи тегло на разтвора, както и размерът на обема на разтвора, в който се намира.
3
Пример 1: определя титъра на 15% разтвор на сярна киселина. Плътността на разтвора е 1,10 g / ml. Концентрацията на разтвора се изразява в масата на веществото. Масовата фракция е съотношението на масите на разтвореното вещество и разтвора. Изчислете масата на един литър от разтвора - 1100 грама. Определете масовото съдържание на сярна киселина в нея: 1100 * 0.15 = 165g. Изчислете титъра на разтвора: 165 g / 1000 ml = 0,165 g / ml.
4
Пример 2: се изисква титър от 0,15 N. разтвор на сярна киселина. Нормалността на разтвора е количеството еквивалент на разтвореното вещество на литър разтвор, единица - mol - eq / l. Еквивалент е количеството вещество, еквивалентно на 1 мол водородни йони при химични реакции. Един литър от разтвора съдържа 0,15 мол еквивалент на сярна киселина.
5
Използвайки периодичната таблица, намерете моларкатамасата на H2SO4 е 98 g / mol. Еквивалент на сярна киселина - 1/2. Изчислява се молната маса на еквивалентната H2SO4: 98/2 = 49 g / mol. Намерете колко тежи 0,15 мол еквивалент на сярна киселина: 0,15 * 49 = 7,35 г. Определете титъра на разтвора: 7,36 г / 1000 мл = 0,00736 г / мл.
6
Във втория тип задачи е необходимо да се намери условен титър. За разтвора изчислете от първоначалните стойности масата на разтвореното вещество и обема на разтвора, с който реагира.
7
Пример 3: изчислете титъра на разтвора 0,1N. разтвор на AgN03 в NaCl. Еквивалентите на AgNO3 и NaCl са еднакви. Намерете моларната маса на NaCl - 58,5 g / mol. Намерете количеството сребърен нитрат в 1 ml от разтвора - 0,0001 mol. Следователно количеството натриев хлорид, реагиращо с 1 ml от разтвора, е 0,0001 mol. Умножете моларната маса на NaCl с количеството на веществото и вземете конвенционалния титър на разтвора на сребърен нитрат - 0,000585 g / ml - масата на NaCl, взаимодействайки с 1 ml разтвор на амониев хлорид.
8
Третият вид задача е да се изчисли титъра на разтвораот стойностите, получени по титриметричния метод. За да ги решим, разчитайте на уравнението на реакционните реакции. От него открийте в каква степен веществата взаимодействат помежду си.
9
Пример 4: определете титъра на разтвора на HCl, ако неутрализирането на 20 ml киселина изисква 18 ml от 0,13 N. разтвор на NaOH. Еквивалентите на HCl и NaOH са еднакви. Намерете количеството натриев хлорид в 18 ml: 0,13 * 0,018 = 0,00234 mol. Следователно, количеството на преобразуваната солна киселина също ще бъде 0,00234 мола. Изчислява се молната маса на НС1 - 36,5 g / mol. Намерете масата на полученото количество солна киселина: 0.00234 * 36.5 = 0.08541 g. Тази маса на веществото се съдържа в 20 ml от разтвора. Намерете титъра на разтвора: 0,08541 / 20 = 0,0042705 g / ml.
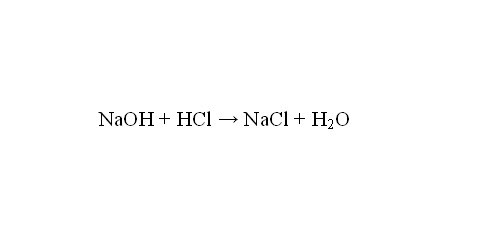
Съвет 2: Намиране на титъра на решението
титър разтвор е един от условията законцентрация (заедно с процентна концентрация, моларна концентрация и т.н.). Стойността на титъра показва колко грама от веществото се съдържат в един милилитър разтвор.

инструкция
1
Да предположим, че тази задача е дадена. Има 20 милилитра разтвор натриев хидроксид. За да се неутрализира, е необходимо да се използват 30 милилитра от 1М разтвор солна киселина. Никое от веществата не беше взето в излишък. Определете какъв е алкалния титър.
2
На първо място, напишете реакционното уравнение. Провежда се както следва: NaOH + HCI = NaCl + Н20.
3
Виждате, че по време на тази реакция на неутрализация,според уравнението, броят на моловете на киселината напълно съвпада с броя на молекулите на алкалните, свързани с него. И колко бенки от киселина влязоха в реакция? След като решението му е неморално, броят на бенките ще бъде толкова по-малък от един, колко пъти 30 милилитра по-малко от 1 литър. Тоест, 30/1000 = 0,03 mol.
4
От това следва, че алкалът също е 0,03 mol. Брой колко ще е това в грамове. Молекулното тегло на натриевия хидроксид е приблизително 23 + 16 + 1 = 40, поради което молната му маса е 40 g / mol. Умножете 40 по 0,03, получавате: 1,2 грама.
5
Е, тогава всичко е много просто. 1,2 г алкали се съдържат в 20 милилитра разтвор, Разделяйки 1,2 на 20, получете отговора: 0,06 грама / милилитър. Тук има надпис за разтвор натриев хидроксид.
6
Ние усложняваме състоянието на проблема. Да предположим, че имате същата сума разтвор натриев хидроксид - 20 милилитра. За да се неутрализира, бяха прибавени същите 30 милилитра 1М солна киселина. За разлика от предишната задача обаче се оказа, че киселината е взета в излишък и за неутрализирането й е било необходимо да се използват 5 милилитра от 2М разтвор калиев хидроксид. Какво е заглавието? разтвор натриев хидроксид в този случай?
7
Започнете, като напишете уравнението за реакцията на киселина с каустик калий: HCl + KOH = KCl + H2O.
8
Мотивиране, подобно на горния пример ище видите: първо, първоначално хлороводородната киселина е 0,03 мола и на второ място, в реакция с въведената киселина 2x0,005 = 0,01 мола каустик поташ. Тази алкална, съответно свързана 0,01 мола солна киселина. Следователно, 0,03-0,01 = 0,02 мола хлороводородна киселина се взима към първата реакция с друг алкал, сода каустик. От което става ясно, че натриевият хидроксид в разтвора съдържа 0.02 мола, т.е. 40х0.02 = 0.8 грама.
9
И тогава определете титъра на това разтвор - никъде не е лесно, в едно действие. Разделяйки 0,8 на 20, получете отговора: 0,04 грама / милилитър. Решението на проблема отне малко по-дълго, но нямаше нищо сложно.